|
|
Cranioplastica |
|

|
|
|
Dalla
noce di cocco all'idrossiapatite:
storia
della cranioplastica
A.
Verlicchi, B. Zanotti
FONTI NON SCRITTE
L’inserimento di una protesi sul cranio a copertura di un difetto osseo è una procedura che risale agli albori della storia della medicina, costituendo di solito la fase riparativa della trapanazione cranica.
In mancanza di fonti scritte, le indagini di paleopatologia, ossia lo studio dei reperti ossei o delle mummie sui quali siano rimasti segni di interventi terapeutici o ritenuti tali, hanno evidenziato che la trapanazione cranica era già praticata dall’uomo in epoca preistorica. Era un atto religioso magico-rituale, ma esistono prove che venisse effettuata anche a scopo terapeutico. I primi interventi di questo tipo risalgono al mesolitico (10.000-7.500 a.C.).
Nelle epoche successive la trapanazione ha poi conosciuto un incremento notevole. Nel neolitico (7.500-5.300 a.C.) era ampiamente praticata e se ne trovano esempi anche in Italia, come il cranio di Catignano (Pescara), che risale al V millennio e che sembrerebbe il più antico esempio italiano di cranio con trapanazione. La più antica testimonianza in Europa è stata, invece, rinvenuta a Ensisheim, in Alsazia, ed è datata 7.000 a.C. Interessante pure il ritrovamento, nella necropoli neolitica di Loisy-en-Brie in Francia, di un cranio trapanato, in cui è presente il lembo osseo a chiusura del foro (Figura 1).
 |
Figura 1. Cranio
trapanato della necropoli di Lois-en-Brie della fine del neolitico.
L'assenza, attorno al lembo osseo, di cicatrizzazione indica che il
soggetto non è sopravvissuto.
|
Anche i Celti del neolitico eseguivano fori nel cranio e utilizzavano i pezzi d’osso ottenuti, di forma rotonda od ovale, probabilmente come amuleti, ma non come cranioplastiche, in quanto non esistono prove osteologiche che siano stati usati in tal senso.
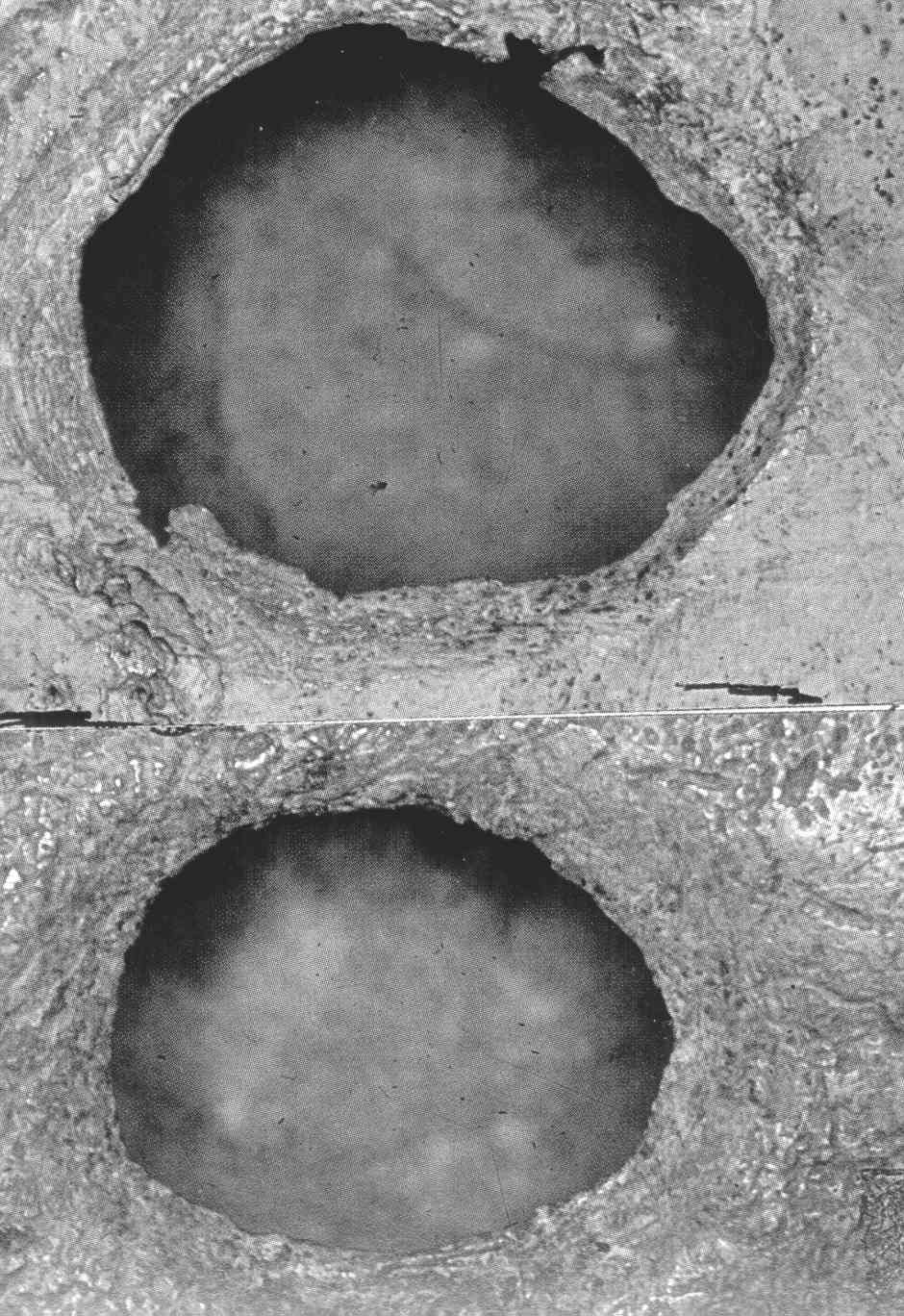
La trapanazione era ampiamente diffusa in Europa, in Asia e nell’America del Sud e non è esagerato dire che migliaia di anni fa si trapanava più o meno comunemente. Questi interventi sorprendono ed affascinano per diverse ragioni: innanzitutto la loro attuazione nonostante la non conoscenza dei moderni principi di asepsi e di anestesia, poi l’alta percentuale di successo e la relativamente bassa mortalità delle operazioni, infatti più della metà dei crani, sottoposti a trapanazione mostrano escrescenze ossee intorno al foro, segno di crescita riparativa che documenta la sopravvivenza post-operatoria dell’individuo (Figura 2), infine per la loro ampia diffusione nel tempo e nello spazio.
 |
 |
|
Figura
2. Fori di trapanazione preistorica. A sinistra periodo
neolitico, Valle del Petit-Morin (cicatrizzati). A destra,
epipaleolitico, Taforalt (senza abbozzo di cicatrizzazione). |
Nell’America del Sud Pre-colombiana, tutti i popoli nativi, dagli Aztechi ai Maya agli Incas, eseguivano la trapanazione del cranio (Figura 3).
 |
|
Figura
3. "The Inca trephination mural" di Altan S. Tobey al
Smithsonian Institution, Washington D.C. (USA). |
Una ricerca su più di 10.000 mummie pre-Incas del Perù ha evidenziato che più di 500 (il 5%) hanno una trapanazione del cranio, talora ripetuta e con fori di varie dimensioni. In alcuni crani sono anche state evidenziate cranioplastiche di diverso materiale: oro, argento, il guscio delle noci di cocco o di zucca o di calabash (Figura 4).
 |
Figura 4.
Calabash: frutto di un albero tropicale. Il guscio di questo frutto
è stato usato come materiale per le cranioplastiche.
|
L’uso dei materiali meno nobili probabilmente non dava un buon esito, infatti sono stati rinvenuti molti crani con osteomielite, ed era riservato ai cittadini comuni. I metalli preziosi erano, invece, destinati alla nobiltà. Esempi di queste antiche protesi sono ospitati in diversi musei, famosi il cranio con placca d’oro del “Museo de Oro” a Lima in Perù (Figura 5) e quello con lamina d’argento del Museo di Semmelweis a Budapest in Ungheria. La conferma che le cranioplastiche venivano eseguite pre-mortem deriva dal fatto che il cranio ingloba saldamente il corpo estraneo.
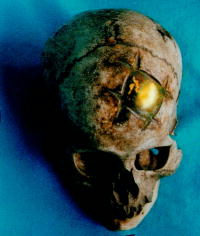 |
Figura 5.
Cranioplastica d'oro, conservata al Museo de Oro di Lima.
|
Anche in alcune isole del Sud Pacifico gli studi archeologici hanno trovato che le popolazioni primitive usavano il guscio di una noce di cocco per riparare le lacune del cranio.
La diffusione della trapanazione e della cranioplastica sembra, pertanto, fosse estesa in tutti i continenti.
Il mondo preistorico rinvenuto è pieno di esempi di trapanazione, ma non di cranioplastiche e tale stato di cose continua negli anni successivi, sino a quando finalmente incominciano le prime esposizioni scritte.
FONTI SCRITTE
La prima descrizione scritta viene fatta risalire a Gabriele Falloppio (1523-1562), anatomista e chirurgo italiano, che nella sua Opera Omnia (raccolta di lavori pubblicata postuma, nel 1582) consiglia di riposizionare, entro due ore, l’osso non contaminato se la dura madre è ancora intatta, ma di rimuoverlo se la dura non è più integra e di utilizzare una lamella d’oro.
Diversi chirurghi, suoi contemporanei, esprimono “perplessità” sull’impiego di lamine d’oro, convinti che spesso il metallo prezioso finisse nelle tasche di medici senza scrupoli, piuttosto che nel difetto osseo del paziente.
La prima notizia storica di innesto d’osso nella breccia cranica si deve, nel 1668, al chirurgo oladandese Job Hanszoon van Meekeren (1611-1666), che riporta il caso, di cui aveva avuto comunicazione da un ecclesiastico, di un nobile moscovita di nome Butterlijn. Gli era stata riparata una lacuna cranica, provocata da un colpo di spada, con parte del cranio di un cane. L’intervento era perfettamente riuscito ed il paziente esultante aveva incominciato a raccontare l’evento ai suoi amici e conoscenti, che passarono la notizia ai chierici e questi ultimi all’arcivescovo, col risultato che venne emessa una scomunica, che gli proibiva l’accesso, in tutta la Russia, ai luoghi di ritrovo dei cristiani finché avesse avuto quel pezzo “vietato” in testa. La Chiesa, infatti, riteneva la testa di un cristiano troppo pura per poter essere inquinata con ossa d’animale. Nel tentativo di riconciliarsi con la Chiesa, il paziente ordinò al suo chirurgo di rimuovere l’osso di cane. Purtroppo il medico non riuscì nell’intento, perché l’innesto si era già saldamente unito alle ossa del cranio. Butterlijn allora lasciò la Russia per sfuggire alla scomunica.
Bisogna però aspettare fino il XIX secolo affinché venga riconosciuta l’utilità clinica dell’innesto osseo, la cui applicazione nell’uomo è preceduta da esperimenti sugli animali.
Nel 1810 D.C.T. Merrem realizza diverse trapanazione su cani e gatti con riposizionamento dell’opercolo osseo, che si consolida poi sulla scatola cranica. Nel 1821 Philip von Walther, sull’esempio di Merrem, riposiziona il tappo osseo sul foro di trapanazione in un cranio umano e nota una parziale guarigione, non completata per l’insorgenza di una suppurazione della ferita.
Anche Louis Xavier E. Olliver, clinico di Lione ed uno dei pionieri degli studi sulla rigenerazione ossea, esegue trapanazioni ed innesti ossei sugli animali. Dimostra, nel 1859, l’importanza del periostio negli innesti, infatti il tessuto osseo fresco ricoperto dal periostio rimane vitale, e poi anche il ruolo osteogenico della dura madre. Inoltre, è tra i primi a distinguere i concetti di autoinnesto, alloinnesto e xenoinnesto.
Per inciso, ricordiamo che, in generale, l’innesto può essere differenziato in:
- auto-innesto (“autograft”) o innesto autogeno o autologo o autoplastico, quando il tessuto è prelevato e successivamente reimpiantato al medesimo organismo;
- allo-innesto (“allograft”) o omo-innesto o innesto omologo o omoplastico o allogenico, quando il tessuto viene distaccato da un donatore, vivente o non, appartenente alla stessa specie del ricevente;
- etero-innesto o xeno-innesto (“xenograft”) o innesto eterogeno o eterologo o eteroplastico o xenoplastico, quando il tessuto proviene da un donatore di specie vivente diversa dal ricevente;
- innesto con alloplastica o innesto alloplastico (“allopastic graft”), se costituito da materiale sintetico o, comunque, non proveniente dal mondo animale .
Nel 1873 Sir William Macewen reimpianta frammenti di calvaria dopo averli trattati con bicloruro di mercurio. Gli studi di questo famoso chirurgo, ritenuto il padre della pratica moderna di innesto osseo, sono considerati fondamentali.
Nel 1889 N. Senn scrive sulla riparazione di difetti cranici con osso antisettico decalcificato. Nello stesso anno si apre definitivamente l’era della moderna cranioplastica con Seydel, che ripara con successo una lacuna ossea parietale con un graft osteo-periosteo cesellato dalla tibia e sottile pochi mm.
Negli anni successivi si succedono gli innesti di osso autologo, prelevato da varie parti del corpo.
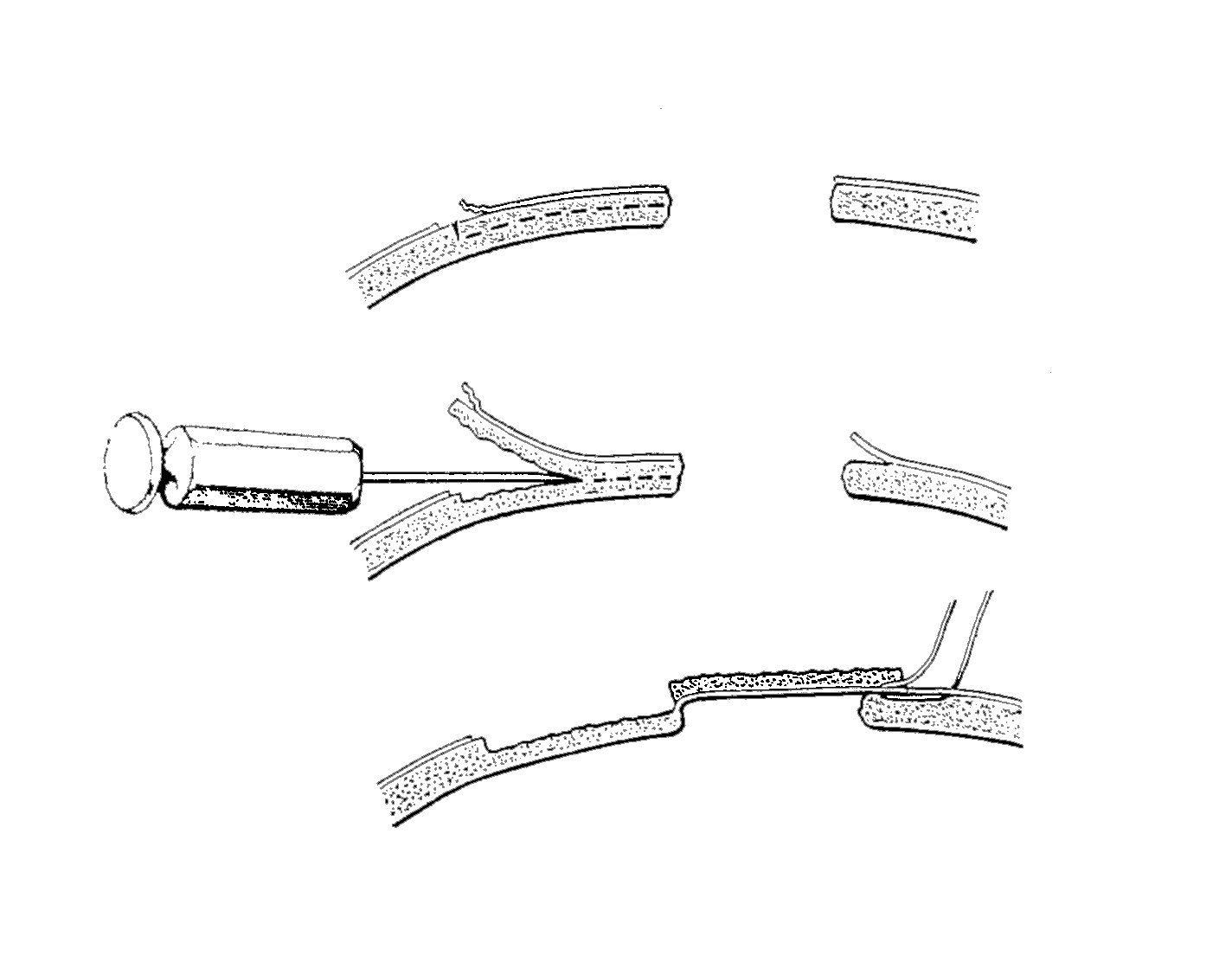
Nel 1890 W. Müller e F. König, indipendentemente propongono di far scorrere, sul difetto del cranio, il vicino tavolato esterno della volta cranica (Figura 6), mantenendo l’integrità del periostio e della vascolarizzazione. Questa tecnica incontra un enorme successo.
Nella storia della civiltà umana si arriva poi al periodo delle due grandi guerre mondiali. I conflitti militari, per intrinseca natura, hanno sempre permesso di poter disporre di una notevole casistica su cui sperimentare diversi approcci terapeutici e questo vale anche per la cranioplastica.
Negli anni ’20 H. Delangeniére, presso l’ospedale di Mans in Francia, realizza ben 104 cranioplastiche con innesti osteo-periostei autologhi prelevati dalla cresta tibiale, con eccellenti risultati.
Nel periodo bellico è utilizzato intensamente anche l’impianto di tessuto osseo o cartilagineo da altro individuo. Si sviluppa pure la pratica dell’innesto osseo omologo prelevato da cadavere. J.A. Sicar e C. Dambrin, dal 1917 al 1919, effettuano con successo di 120 impianti protesici di questo tipo.
La necessità di conservare l’osso e mantenerlo sterile, fino al suo riposizionamento con un secondo intervento chirurgico, ha anche stimolato le ricerche sui metodi di mantenimento del materiale osseo. I procedimenti più datati prevedevano la bollitura dell’osso o la sua protezione in alcol e mercurio. La bollitura distrugge però il potenziale osteogenico dell’osso ed aumenta la tendenza alle infezioni ed al riassorbimento. Una pubblicazione del 1947 di casi così trattati evidenzia come il posizionamento in un secondo tempo dell’osso bollito si associa ad una maggiore tendenza alla infezione della ferita ed all’atrofia ossea, non riscontrabile invece quando si ricolloca immediatamente l’osso.
Pure il passaggio in autoclave sembra predisporre all’infezione o alla necrosi asettico dopo il reimpianto, ma non è un’esperienza unanime, alcuni riportano una guarigione senza complicazioni.
Nel 1916 incomincia ad essere testato un nuovo metodo: la preservazione del pezzo cranico nella parete addominale. Questa tecnica però produce una cicatrice poco estetica e mantiene solo parzialmente la vitalità dell’osso, infatti è stato dimostrato che, quando quest’ultimo viene privato della sua irrorazione ematica e collocato nel tessuto fresco, muore, ad eccezione di uno strato di cellule superficiali, profondo meno di un millimetro. Lo sviluppo di altre procedure di conservazione ne ha determinato l’abbandono.
Il successo della conservazione dei cibi mediante congelamento, induce la sperimentazione dello stesso metodo con i tessuti e gli organi necessari per i trapianti. Nel 1945 L.F. Bush apre nell’Orthopaedic Hospital di New York la prima banca dell’osso ed evidenzia che l’osso può essere mantenuto sterile fino a 3 settimane a 2-5°C e fino ad un tempo indeterminato a -25°C. Negli anni questa osservazione è stata confermata ed attualmente il metodo vigente per la preservazione dei flap ossei è il congelamento a -80°C. La matrice ossea congelata si preserva meglio rispetto ai metodi che utilizzano il calore.
Ricordiamo che il congelamento uccide le cellule responsabili del rigetto. In pratica, l’osso è devitalizzato e si innesta solo la matrice inorganica del donatore, che sarà ripopolata naturalmente dalle cellule midollari del ricevente.
A partire dalla fine dell’800 si assiste anche ad un marcato incremento dell’uso, mai abbandonato fin dalle epoche più remote, di protesi alloplastiche, con un’ampia varietà di materiali (varie plastiche e metalli). Questo grazie anche all’introduzione degli antibiotici, scoperti nel 1928. Anno in cui Alexander Fleming, un medico inglese, identifica casualmente la sostanza che più tardi chiamerà penicillina, prodotta da un muffa che aveva attaccato una coltura di stafilococchi.
Nel 1890 viene sperimentata su vasta scala la celluloide, poi abbandonata per le reazioni cellulari ed i processi biodegradativi dei tessuti. Nel 1893 l’alluminio è uno dei primi metalli ad essere sperimentato, seguito negli anni ’40 dal vitallio, dal ticonio, dal tantalio (materiale di scelta durante la II Guerra Mondiale), dalle reti di acciaio inossidabile e, negli anni ’60, dal titanio.
I metalli sono solidi, malleabili e sterilizzabili, ma si corrodono, conducono il caldo, si infettano, possono essere epilettogeni e sono relativamente radioopachi. L’impossibilità di ottenere chiare visualizzazioni radiologiche è la principale ragione per cui molti chirurghi incominciano a cercare sostituti non metallici dell’osso.
Tre anni dopo che le resine acriliche erano diventate disponibili come materiale industriale, nel 1940, è introdotto nella cranioplastica il metilmetacrilato e nel 1967 viene segnalato che l’incorporazione di una rete di acciaio inossidabile lo rende meno fragile.
Nel 1949 si utilizza per la prima volta il polietilene, altro materiale non metallico, che però non ha mai trovato largo impiego per la difficoltà di ottenere la giusta forma. Al contrario, l’idrossiapatite, usata clinicamente dagli anni ’80, nel tempo ha ottenuto sempre più consensi, in particolare quella porosa.
Verso la metà del XX secolo, il miglioramento delle conoscenze dei processi immunologici (particolarmente
l’istocompatibilità, cioè la compatibilità tissutale tra donatore e ricevente) e la trasmissione di malattie, in ispecie virus, in seguito a trapianti d’organo o parti di cadavere portano al declino degli innesti ossei omologhi ed eterologhi. Come risultato di ciò, l’osso autologo, che era stato parzialmente messo da parte in favore dei nuovi materiali alloplastici, viene reintegrato come il materiale più adatto, sicuro e naturale per le ricostruzioni craniche. Prima della conclusione della seconda guerra mondiale, è già ampiamente condivisa la teoria che, quando possibile, l’innesto di osso autogeno debba costituire la procedura di scelta.
L’utilizzo però di autoinnesti non è sempre possibile, da qui la necessità di poter disporre di valide alternative e la continua ricerca del migliore materiale “alternativo” per riparare queste lesioni.
I materiali più diffusi al giorno d’oggi sono: l’osso autologo, l’idrossiapatite porosa, il metilmetacrilato ed il titanio.
Molti materiali provati per le cranioplastiche sono stati abbandonati a causa degli svantaggi che possono presentare, quali: scarsa disponibilità, costo elevato, reattività biologica, corrosione, difficoltà nel modellamento, peso eccessivo, fragilità, ionizzazione, termolabilità, incompatibilità EEG, TC e RM, radioopacità, antigenicità e riassorbimento.
I MATERIALI
La lacuna della scatola cranica è stata colmata principalmente con: osso (o altri materiali biologici) e con sostituti biocompatibili dell’osso (metallici o non).
Osso o altri materiali biologici
Reimpianto dell’opercolo cranico. Nel 1885 l’inglese W. Macewan reimpianta con successo i pezzi d’osso asportati con la trapanazione e diffonde questa procedura di reintegrazione “immediata”.
Innesto d’osso autologo. A riempimento del difetto cranico è stato inserito un pezzo d’osso prelevato da diverse parti dello scheletro, tra cui:
• cranio. Nel 1890 si prepara, accanto alla lacuna, un flap osteo-periosteo, slaminando il tavolato esterno della teca cranica (“splitting”), e poi si sposta il lembo peduncolato a copertura del difetto cranico e lo si fissa al circostante periostio. Il flap osteo-periosteo è mantenuto vivo dal suo peduncolo periosteo. Da allora questa tecnica è stata ripetutamente modificata e migliorata. L’osseo, oltre che dalle aree adiacenti alla perdita di sostanza, è stato anche prelevato dal lato opposto del cranio. Il trapianto del tavolato esterno del cranio non è immediatamente stabile, pertanto dopo l’intervento venivano applicati bendaggi compressivi e, se il difetto era di apprezzabile entità, si preferiva tenere il paziente in posizione orizzontale per circa una settimana. Secondo alcuni autori, poi, non era necessaria una chiusura assoluta del difetto osseo, in quanto la guarigione era possibile anche con una lieve diastasi.
|
|
|
Figura
6. Disegno schematico che mostra la preparazione del flap
osteo-periosteo dal tavolato del cranio e suo spostamento sul
difetto osseo. |
• tibia. Nel 1889 Seydel introduce l’innesto osteo-periosteo tibiale. Tale procedura è applicata per diversi anni soprattutto a difetti cranici relativamente piccoli con ottimi risultati. H. Delangeniere, che tra il 1916 ed il 1935 sviluppa molto bene questa tecnica, riporta solo due insuccessi su 104 casi e, di questi, uno rioperato con esito positivo. Tuttavia, la metodica presenta diversi svantaggi: le dimensioni ridotte della superficie di rimozione, la mancanza di convessità del pezzo, la possibile frattura della tibia, la necessità di due campi operatori, nonché il dolore che residua all’arto, infatti, come ebbe a dire un chirurgo, i pazienti si lamentano della loro gamba più che della loro testa.
• coste. Nel 1915 è impiegata per la prima volta, per coprire un difetto cranio-durale, una costa con il suo periostio e grasso. Inizialmente si usava la costa a tutto spesso, poi si preferì un prelievo parziale per lasciare la lamina interna della costa a protezione del contenuto toracico. Le coste rigenerano rapidamente e perciò possono essere usate di nuovo, quasi come una inesauribile banca di osso autologo. Inoltre, sono flessibili, facilmente modellabili con uno scalpello, particolarmente adatte nella ricostruzione del profilo dell’arcata sopra-orbitaria. Negli ampi difetti cranici venivano, però, inserite più coste e questo determinava il cosiddetto effetto “onda”, in cui il contorno delle singole coste poteva essere visto o palpato sulla cute. Ciò, nelle parti non coperte dai capelli, deturpa la regolarità del profilo. Nonostante i vantaggi biologici e tecnici, anche se non sempre estetici, tale metodica non ha però ricevuto una grande considerazione.
• osso iliaco. Durante la I Guerra Mondiale si sviluppa l’uso dell’innesto prelevato dalla cresta dell’osso iliaco. Tale procedura permette di poter disporre di innesti ampi, con una forma concava-convessa che, assomigliando ai contorni del cranio, dà un buon risultato estetico; tuttavia necessita di due esposizioni chirurgiche e di un intervento lungo, con un’abbondante perdita di sangue dovuta alla muscolatura dell’area iliaca. Inoltre, nei bambini può indurre problemi di crescita.
• scapole e sterno. Risale al 1912 il primo intervento con graft autologo dall’area scapolare e tre anni dopo si pratica quello con innesto sternale. I graft scapolari e sternali hanno il periostio da entrambi i lati ed una naturale convessità. A parte questo, tali innesti non hanno particolari vantaggi, ed infatti dalla letteratura si evidenzia che non hanno incontrato grande entusiasmo.
Innesto d’osso omologo. Fin dal 1917 vengono riferiti risultati molto soddisfacenti con l’uso di parti craniche rimosse da cadavere. Da quest’ultimo può essere prelevato proprio il segmento osseo corrispondente alla posizione del difetto cranico del paziente e questo rappresenta un indubbio vantaggio. L’osso “morto” trapiantato funziona come un conduttore progressivamente colonizzato dalle cellule del tessuto osseo “vivo” circostante. I tempi di integrazione sono lunghi, infatti per un difetto di 5 cm di diametro occorrono circa 2 anni. Successivamente, però, si ricorse sempre meno alla procedura di innesti omologhi da cadavere a causa dei numerosi casi di rigetto ed infezione.
Innesto d’osso eterologo. In diverse occasioni sono state trapiantate ossa provenienti da altre specie animali. Dopo Meekren, sono state, con successo, utilizzate una epifisi femorale ed un osso iliaco di cane. Oltre che dal cane, sono state prelevate e bollite ossa d’aquila, di vitello, di pecora, di bue, di coniglio, di buffalo e di tartaruga. A parte questi ultimi due, in cui veniva rispettivamente asportato il corno e la placca cornea, in genere veniva presa la scapola dell’animale. I risultati riferiti sembrano soddisfacenti, ma tale metodica non attecchisce per il successo incontrato dagli autoinnesti e dagli innesti alloplastici, finché non si è giunti a processi di conservazione e di sterilizzazione ottimali.
Innesto d’osso demineralizzato Nel 1889 viene utilizzato osso decalcificato per riparare difetti cranici con buoni risultati. In generale, l’osso demineralizzato può essere usato per i difetti craniofacciali con una minima reazione tissutale e scarsa attività
osteoclastica. Da 8 a 12 settimane dopo l’impianto si evidenzia la crescita di osso nuovo, soprattutto nella parte durale e nelle parti in continuità con la superficie dell’innesto. Ha diversi vantaggi, come la flessibilità e la facile modellabilità. Nell’osso demineralizzato è stato rimosso il calcio per esporre le cosiddette “bone morphogenic proteins” (BMP), che stimolano la rigenerazione dell’osso. Va precisato che sia il tessuto osseo “manipolato” (demineralizzato) sia quello “non manipolato” sono entrambi tessuti non vitali.
Innesto di cartilagine o di altri tessuti. L’uso di cartilagine (omologa o autologa) o del muscolo temporale o della fascia muscolare, nonché di grasso, riportata in alcuni
report, è limitata a casi con difetti piccoli ed inoltre comporta un inadeguato supporto strutturale.
In particolare, la metodica degli innesti di cartilagine, tessuto facilmente modellabile e relativamente resistente alle infezioni e le cui prime ricostruzioni risalgono al 1915, è accolta con entusiasmo ed attuata da diversi chirurghi. Le ricostruzioni dei difetti cranici con cartilagine presa da altri pazienti vanno molto durante la I Guerra Mondiale. L’esperienza poi mostrerà che in realtà i vantaggi sono minimi e che, invece, la rimozione di una o più cartilagini costali comporta: un secondo intervento non serio ma abbastanza dolorosa, una deformità minima ma reale ed una cicatrice fibrosa e spesso un riassorbimento rapido dell’innesto.
In generale, l’osso autologo è il materiale più naturale, sicuro e conveniente per la cranioplastica ed il più indicato nei bambini, in quanto permette un accrescimento armonico del cranio. Benché abbia una modellabilità relativa, presenta un basso rischio di infezione ed è evidente che non esistono problemi di rigetto. Inoltre, il tessuto innestato conserva una notevole cellularità, mentre viene annullata la possibilità di trasmissione di patologie infettive. Per tali motivi, quando è possibili eseguirli, gli innesti autogeni vengono considerati di prima scelta. I siti attualmente preferiti per i prelievi autologhi sono il cranio, le coste e l’osso iliaco. Gli innesti con coste o con osso iliaco sembrano associarsi ad un minore riassorbimento, probabilmente per il diverso rapporto della componente corticale e spongiosa. Nella scelta della sede del prelievo occorre tenere presente che: le ossa del cranio hanno una scarsa componente spongiosa, sono fragili, di spessore esiguo nei bambini e la loro manipolazione presenta difficoltà tecniche; gli innesti con coste, che hanno il vantaggio di essere curve e sottili, spesso però sono gravati da complicazioni nella sede del prelievo, infatti nel 12% dei casi compare un pneumotorace; infine nei graft con l’osso iliaco, adatto quando è necessario un ampio segmento osseo spongioso, spesso compare, dopo il suo prelievo, un dolore persistente.
Gli innesti di osso autologo, biologicamente senz’altro i migliori, hanno tuttavia dei limiti importanti. Infatti, non tutti i pazienti, ad esempio, sono disposti a sottoporsi a prelievi di osso, né tutti si trovano nelle condizioni generali di salute compatibili con interventi di prelievo di grandi quantità di osso, come per esempio le creste iliache. A causa di queste limitazioni sono stati ripresi gli alloinnesti, in genere prelevati da cadaveri, valutati attentamente secondo determinate linee guida e sottoposti a una serie di processi fisici o chimici per prevenire la trasmissione di malattie infettive e per minimizzare il rischio di rigetto. In genere il tessuto osseo, una volta prelevato, viene demineralizzato e successivamente congelato. Sia l’eliminazione della componente inorganica sia il congelamento sembrano aumentano le proprietà osteoconduttive dell’innesto posizionato nel sito ricevente. Molto probabilmente la demineralizzazione aumenta la disponibilità di una serie di fattori di crescita che, per osteoinduzione, promuovono la crescita di nuovo osseo nel sito ricevente. L’osso omoplastico è disponibile presso le banche di osso, che hanno il compito di raccogliere, valutare d’idoneità, processare, crioconservare e ridistribuire i campioni ossei prelevati a scopo d’innesto.
Sostituti biocompatibili dell’osso
Metallici
Alluminio. Il primo tentativo di riempire un difettivo cranico per mezzo di una lamina di questo metallo risale al 1893. Il paziente morì 10 giorni dopo l’intervento. Successivamente anche altri riportarono questo utilizzo.
Oro. Nel 1895 si riprese la procedura di inserire una placca d’oro. Il paziente così operato fu seguito per 2 anni e mezzo e non gli fu riscontrato alcuna reazione avversa. Nel 1917 in Francia furono pubblicati i risultati di 100 casi di cranioplastica d’oro. In questa casistica solo 2 pazienti erano morti per infezione e 2 avevano dovuto rimuovere l’impianto per suppurazione della ferita. In questi ultimi, la lamina era stata trovata fermamente fissa ed in buona posizione.
Argento. Il suo utilizzo è raccomandato e praticato in Francia agli inizi del 1900. Riferiti casi trattati con successo anche in Inghilterra. Vengono segnalate reazioni all’ossido che si forma sull’argento e scoloramento della cute sopra la placca.
Platino. Nel 1929 viene descritto l’uso di questo metallo, che rimase in sede cranica per almeno 14 mesi senza provare alcun segno di reazione. Il costo di questo materiale ne precluse ovviamente il consumo.
Piombo. Nel 1908 si ha la prima notizia dell’uso di piombo per una cranioplastica. Come prevedibile, il paziente però sviluppò una intossicazione saturnina. Questa complicanza ne controindica l’impiego.
Vitallio. Nel 1937 viene suggerito l’uso di questa lega di cobalto, cromo e molibdeno, che negli esperimenti elettrolitici in vitro aveva dimostrato di essere chimicamente inerte e quindi molto resistente alla corrosione. Inizialmente sviluppato per le placche dentali, fu il primo metallo non puro ad essere utilizzato nella riparazione dei difetti cranici. Fu usato per alcuni anni, poi abbandonato per la mancanza di malleabilità.
Ticonio. Composto di cobalto, cromo, nickel e molibdeno, fu proposto come materiale per la cranioplastica nel 1941. Come il vitallio è inerte, solido e leggero, però è malleabile. Sarebbe potuto diventare il metallo più diffuso, se la II Guerra mondiale non ne avesse fermato i trials clinici.
Tantalio. Scoperto nel 1802, il 73esimo elemento della tavola periodica è proposto come materiale per la cranioplastica nel 1942, dopo esperimenti sugli animali che avevano mostrato che non determina reazioni tissutali. La sua introduzione e generale accettazione blocca per un certo tempo gli esperimenti con altri metalli. Ha un notevole impulso durante la II guerra mondiale. Sembrava essere un materiale ideale, era un composto noto, essendo usato da alcuni decenni nell’industria, poteva essere modellato nella forma desiderata prima dell’intervento, non fu quasi mai vista una risposta infiammatoria del soprastante scalpo o dell’osso adiacente, era inerte, non riassorbile e resistente alla corrosione. Aveva però anche degli svantaggi: la sua estrazione era difficoltosa e pertanto costosa; conduce molto bene il caldo ed il freddo e questo determinava cefalee negli estremi sbalzi di temperatura ed infine è radioopaco e quindi problematico nelle indagini radiologiche. Per queste ragioni finì rimpiazzato dai composti acrilici.
Acciaio inossidabile. Questa lega di ferro, carbonio e cromo fu impiegata nel 1945, verso la fine della II Guerra Mondiale. La rete di acciaio inossidabile era raccomandata solo per piccoli difetti, infatti era così flessibile che il minimo trauma poteva creare deformità permanenti della protesi. Il composto condivide molte proprietà del tantalio, ma rispetto a questo è molto più economico: 1/290 del suo prezzo.
Titanio. Il 22esimo elemento della tavola periodica, scoperto nel 1796, diviene commercialmente disponibile nel 1946 grazie ad un processo chimico di riduzione ed è usato per la prima volta in una cranioplastica nel 1965. Risultava molto meno riducente del tantalio e notevolmente meno costoso. Inoltre era biocompatibile e solido, purtroppo era difficile da modellare
intra-operatoriamente.
Non metallici
Celluloide. È stata usata nel 1890. La sua disponibilità e flessibilità portano al suo ampio uso dapprima in Austria, poi in Germania e quindi su più ampio raggio. L’entusiasmo viene però smorzato dalla reazione cellulare esuberante e dal essudato sieroematico che si forma intorno alla placca e che richiede frequenti aspirazioni ed in alcuni casi causa la formazione di fistole. Nonostante questi problemi la celluloide è stata ampiamente usata prima dell’introduzione del tantalio e del metilmetacrilato nel 1940.
Resine acriliche. Già prima della II Guerra Mondiale, le resine acriliche (plastica) erano conosciute come il materiale ideale per le protesi dentali, infatti non inducono quasi alcuna reazione tissutale. Nel 1940, dopo esperimenti sugli animali che non dimostrarono alterazioni durali, viene usato per le cranioplastiche il metilmetacrilato, conosciuto sotto i nomi commerciali di Vitacril, Lucite, Plexiglas, Cristallite o Cranioplastic. I primi preparati erano radiolucenti. Per superare questo problema che non permetteva l’individuazione radiologica delle fratture della protesi e della dislocazione dei suoi frammenti, si impregnarono le placche con un po’ di bario.
Fu introdotta anche una rete metallica di filo d’acciaio inossidabile o di titanio
all’interno delle protesi, per ridurne il suo potenziale di frattura. Le protesi possono essere modellate durante l’atto chirurgico oppure realizzate precedentemente su misura in polimetilmetacrilato, su modello tridimensionale della testa del paziente.
Idrossiapatite. Questo composto di fosfato di calcio, è un minerale che si trova naturalmente nell’osso, costituisce infatti il 60% dello scheletro umano calcificato. È stato prodotto sinteticamente negli anni ’70, mediante un processo di sintetizzazione (agglomeramento di una polvere a temperatura inferiore al punto di fusione), ed è usato clinicamente da circa 20 anni. L’idrossiapatite (HA) è disponibile in due forme: ceramica e non. Solo la prima è quella che finora è stata utilizzata nelle protesi e quella che è più resistente all’assorbimento in vivo. Tutte le forme di HA hanno un’eccellente biocompatibilità e quando posizionate a diretto contatto con l’osso mostrano osteoconduzione e osteointegrazione ed, in presenza di fattori di induzione della crescita ossea, anche osteoinduzione. L’HA ceramica, a sua volta, è disponibile in due forme: densa e porosa. La prima è interamente sintetica, non ha pori e può essere fabbricata in blocchi o granuli, che sono difficili da modellare e non permettono la crescita del tessuto osseo. La seconda può essere prodotta sinteticamente o può essere ottenuta dagli scheletri di particolari coralli marini, chimicamente convertiti. Il vantaggio principale dell’HA porosa è la crescita al suo interno del tessuto osteo-fibroso e quindi la saldatura al tessuto osseo circostante in alcune settimane. Quando la crescita del tessuto osteo-fibroso è completa, l’impianto è costituito per circa il 17% da osso, il 43% da tessuto molle e il 40% da HA.
Oltre all’eccellente legame con l’osso, l’HA provoca scarsa reazione da corpo estraneo, però è estremamente fragile e non flessibile. L’HA porosa ceramica è molto versatile e può essere combinata chimicamente con molti biomaterali per variare le sue proprietà fisiche. Può essere anche usata come trasportatore di materiale attivo biologicamente, come le proteine della crescita ossea, che aumentano la crescita dell’osso nei pori.
Polietilene e silicone. Il polietilene è un composto chimico sviluppato nel 1936, utilizzato inizialmente come isolante nei fili elettrici degli aeroplani ed usato, dopo studi sugli animali, nelle cranioplastiche nel 1949. È soffice e perciò non raccomandato come materiale di supporto. Il suo uso va limitato a difetti di piccole e medie dimensioni che non richiedono un rigido contrafforte (per esempio, nella riparazione di una craniectomia temporale). La gomma di silicone è stata introdotta come materiale cranioplastico nel 1968, ma la sua morbidezza, come quella del polietilene, ne ha impedito l’ampio uso.
Altre sostanze. Sono stati provati numerosi altri materiali per colmare i difetti cranici, quali gomma guttaperca, gesso di Parigi (solfato di calcio emi-idrato), mica, gomma, sughero, ceramica di alluminio e tanti altri ancora.
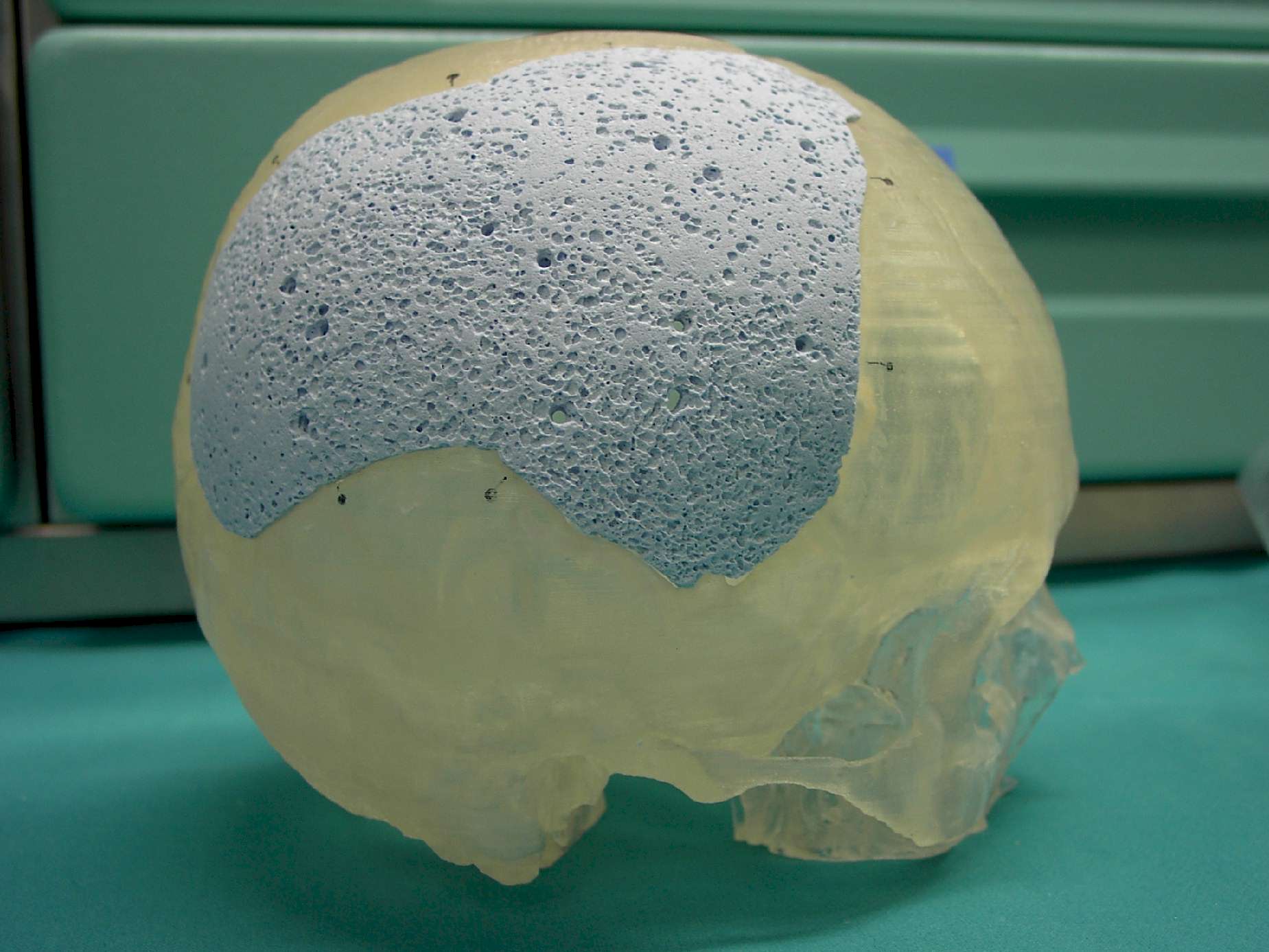 |
Figura 7.
Manufatto in idrossiapatite porosa realizzato con la tecnica "custom
made".
|
CONCLUSIONI
La ricerca del materiale “ideale” da impiegare è attiva da lungo tempo, solcata da progressi ed insuccessi. Nel tempo si è cercato un materiale:
- facilmente modellabile,
- poco costoso,
- comunemente disponibile,
- esteticamente valido,
- biologicamente e chimicamente inerte,
- stabile e duraturo,
- termo-ionicamente inerte,
- leggero ma resistente,
- non antigenico,
- non cancerogeno né corrosivo,
- compatibile con tutti gli esami diagnostici,
- compatibile con la crescita ossea circostante,
- sterilizzabile,
- facilmente impiantabile,
- custom made.
Al di là di alcune caratteristiche fondamentali va da sé però che il principio della cranioplastica vincente risiede nella sua capacità di osteoconduzione e osteoinduzione e con i promettenti risultati ottenuti dall’idrossiapatite porosa in tal senso siamo davvero sulla buona strada!
BIBLIOGRAFIA
1. Artico M., Ferrante L., Pastore F.S., Ramundo E.O., Cantarelli D., Scopelliti D., Iannetti G.: Bone autografting of the calvaria and craniofacial skeleton: historical background, surgical results in a series of 15 patients, and review of the literature. Surg Neurol 2003; 60: 71-79.
2. Caccialanza E.: Il problema delle cranioplastiche dal punto di vista storico ed etio-patogenetico. Min Chir 1983; 38: 815-818.
3. Dallolio V., Monolo L.(a cura di): La cranioplastica. new Magazine edizioni, Trento, 2001
4. Durand J.-L., Renier D., Marchac D.: L’histoire des cranioplasties. Ann Chir Plast Esthet 1997; 42: 75-83.
5. Kim D.J.: The appeal of holes in the head. 17-24. In: The Proceedings of the 13th annual History of medicine days. Health Sciences Calgary, 2004 march 19-20. W.A. Whitelaw, 2004, 17-24.
6. Gosain A.K., Persing J.A.: Biomaterials in the face: benefits and risks. J Craniofac Surg 1999; 10: 404-441.
7. Lecène P.: Cranioplasty and cranial prosthesis (1920). Plast Reconstr Surg 1986; 78: 530-535.
8. Lillie M.C.: Cranial surgery: the epipalaeolithic to neolithic populations of Ukraine. In: R. Arnott, S. Finger, C.U. Smith (editors). Trepanation: history, discovery, theory. Swets & Zeitlinger, The Netherlands, 2003, 175-188.
9. Marino R., Gonzales-Portillo M.: Preconquest peruvian neurosurgeons: a study of Inca and pre-Columbian trephination and the art of medicine in ancient Peru. Neurosurgery 2000; 47: 940-950.
10. Prolo D.J.: Difetti cranici e cranioplastica (Capitolo 204). In: R.H. Wilkins, S.S. Rengachary (a cura di): Trattato di neurochirurgia. Medical Books, Palermo, 1987, 1-11.
11. Rah D.K.: Art of replacing craniofacial bone defects. Yonsei Med J 2000, 41 (6): 756-765.
12. Rawlings C.E. III, Wilkins R.H.: Ceramiche di fosfato di calcio come sostituti dell’osso (Capitolo 19). In: R.H. Wilkins, S.S. Rengachary (a cura di): Neurochirurgia aggiornamento. Diagnosi, tecnica operatoria e neuro-oncologia. Medical Books, Palermo, 1991, 219-225.
13. Reeve D.L.: Cranioplasty. Charles C. Thomas Publisher, Springfield, 1950.
14. Rose L.F., Rosemberg E.: Bone graft and growth and differentiation factors for regenerative therapy: a review. Pract Proced Aesthet Dent 2001; 13 (9): 725-734.
15. Sanan A., Haines S.: Repairing holes in the head: a history of cranioplasty. Neurosurgery 1997; 40 (3): 588-603.
16. Sanen A., Rengachary S.S.: History of calvarial reconstruction. In: S.S. Rengachary, E.C. Benzel (editors). Calvarial and dural reconstruction. The America Association of Neurological Surgeons, 1998, 1-21.
17. Storia della medicina, della farmacia, dell’odontoiatria e della veterinaria (vol. 1). Walk Over Italiana, Bergamo 1982.
18. Stula D.: Cranioplasty. Springer-Verlag, Wien, 1984.
19. Walker A.A.: Neolitic surgery. Archaelogy 1997; 50 (5): 19.
20. Zanchin G.: La neurologia nella storia. Un itinerario sugli sviluppi delle neuroscienze. Milano, Mediamed, 1999.
RINGRAZIAMENTI
Ringraziamo il Prof. Johan A. Persing del Dipartimento di Chirurgia
Plastica dell'Università di Yale per la pronta disponibilità
collaborativa e la Signora Helen Roginiel dello stesso Dipartimento ed il
Dr. Francesco Lupidi del Dipartimento di Neurochirurgia dell'Università
degli Studi di Verona per l'aiuto nel reperimento di materiale
bibliografico.
|
|
![]()









